Soja - Działanie i farmakologia
Chemizm:
Fosfolipidy (45-60%): w szczególności fosfatydylocholina, fosfatydyloetanoloamina, fosfatydyloinozytol
Olej tłusty (30-35%)
Steroidy: Fitosterole (2-5%)
Izoflawony: Genisteina, daidzeina, biochanina A, glicyteina, formononetyna, prunetyna
Izoflawony sojowe - wzór
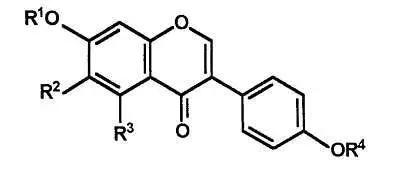
Izoflawony soi oraz ich glikozydy
| R1 | R2 | R3 | R4 | Aglikon | 7-O-Glukozyd (R1) |
H H H H H OCH3 | H H H OCH3 H H | H OH OH H H OH | H CH3 H H CH3 H | Daidzeina Biochanina A Genisteina Glicyteina Formononetyna Prunetyna | Daidzyna Syssotryna Genistyna Glicytyna Ononinamm - |
(Grynkiewicz G. i inni, 2000).
Efekty działania:
Fosfolipidy wyekstrahowane z lecytyny sojowej w eksperymentach na zwierzętach i w próbach klinicznych wykazały zdolność do obniżania poziomu lipidów (Gruenwald J. i inni, 2000).
Genisteina:
Genisteina jest związkiem naturalnym pochodzenia roślinnego, wyodrębnionym po raz pierwszy z Genista tinctoria L. (Janowiec barwierski) ponad sto lat temu. Pod względem strukturalnym należy do klasy flawonoidów - licznej grupy metabolitów wtórnych wywodzących się z fenyloalaniny, których biogeneza funkcjonuje w normalnych warunkach fizjologicznych (np. synteza barwników występujących w kwiatach), ale może też być częścią odpowiedzi na stres środowiskowy (np. wytwarzanie fitoaleksyn). Pod względem chemicznym jest to trójhydroksylowa pochodna 3-fenylochromen-4-onu. Genisteina zajmuje w tej grupie pozycję pod wieloma względami wyjątkową. Po pierwsze, jest obiektem intensywnych badań jako ligand zdefiniowanych biomakromolekuł spełniających ważne funkcje fizjologiczne (receptory estrogenów, kinazy tyrozynowe, topoizomerazy). W efekcie w czasopismach naukowych o profilu przyrodniczym i medycznym ukazuje się corocznie kilkaset artykułów dotyczących różnych aspektów aktywności biologicznej tego związku. Po drugie, znaczna część tych badań weszła w fazę zastosowań medycznych. Pojawiły się już produkty rynkowe o charakterze dodatków do żywności, a zaawansowane są także badania o charakterze przedklinicznym i klinicznym, zmierzające w kierunku nowych leków. Po trzecie, kilka zespołów w Polsce osiągnęło w tej dziedzinie znaczące wyniki. Można tu wymienić badania strukturalne i teoretyczne prowadzone przez prof. A.P. Mazurka (Instytut Leków, Warszawa), badania immunosupresji przez doc. dr. P. Fiedora (AM Warszawa), inicjacji apoptozy i hamowania angiogenezy w komórkach nowotworowych przez prof. Cz. Radzikowskiego (IITD PAN, Wrocław) i badania wpływu genisteiny na regulację metabolizmu przez prof. L. Żogowskiego (Akademia Rolnicza, Poznań). Sytuacja ta skłania nas do zaprezentowania krótkiego i wybiórczego przeglądu wyników dotychczasowych badań nad genisteiną oraz perspektywy jej zastosowań w ochronie zdrowia. Szerszą i bardziej szczegółową dyskusję biochemicznych i farmakologicznych aspektów aktywności genisteiny przedstawili Polkowski i Mazurek (Grynkiewicz G. i inni, 2000).
Soja i genisteina, aktywność, właściwości, wpływ na zdrowie, leczenie raka, ostoporozy, menopauzy
Działanie genisteniy
Genisteina a nowotwory
Jednym z czynników, który zadecydował o wyjątkowym zainteresowaniu genisteiną były wyniki badań dotyczące epidemiologii nowotworów. Wykazały one istnienie związku przyczynowego (korelacja negatywna) pomiędzy spożywaniem znacznych ilości produktów sojowych a zachorowalnością na nowotwory sutka i prostaty oraz śmiertelnością z powodu tych nowotworów. W następstwie tych ustaleń badano poziom genisteiny, która jest głównym flawonowym składnikiem soi (występującym głównie jako glukozyd - genistyna oraz jej estry) w płynach ustrojowych różnych grup kontrolnych i stwierdzono, że w populacjach azjatyckich obserwuje się wielokrotnie wyższe stężenie (od 7 do 110 razy w osoczu i ok. 30 razy w moczu) niż wśród mieszkańców krajów zachodnich. W modelach zwierzęcych stwierdzono hamujący wpływ diety sojowej na proces kancerogenezy indukowany czynnikami chemicznymi lub promieniowaniem. Usunięcie flawonoidów z pokarmu doświadczalnego całkowicie niwelowało ten efekt, wobec czego uznano te związki, oraz jej głównego pod względem zawartości przedstawiciela: genisteinę, za czynnik sprawczy obserwowanych efektów biologicznych. Przedmiotem badań stały się produkty sojowe o różnym stopniu przetworzenia, nader często bez adekwatnej specyfikacji analitycznej. Obecnie przyjmuje się, że całkowita zawartość izoflawonów w surowcach sojowych wynosi 0,1-0,3%. Za główne składniki flawonowe nasion Glycine max Merrill (fasola sojowa) uznane są β-D-glukozydy: genistyna, daidzyna i glicytyna, a odpowiadające im aglikony (genisteina, daidzeina i glicyteina) są praktycznie nieobecne w surowcu (ok. 100 razy mniej niż glikozydów) i pojawiają się w znaczących ilościach dopiero w trakcie technologicznego przetwarzania, pod wpływem obróbki termicznej lub podczas fermentacji. Nowsze i bardziej wnikliwe badania wskazują bezspornie, że stopień złożoności frakcji izoflawonowych z soi jest jeszcze większy. Wśród aglikonów znaleziono dodatkowo formometynę i biochaninę A, co zaś tyczy glikozydów, to stwierdzono, że podstawowymi formami biogennymi są ich estry z kwasem malonowym, a także octowym. Jest oczywiste, że biodostępność, farmakokinetyka i metabolizm tych związków mogą się znacznie różnić, co skłania do daleko posuniętej ostrożności w interpretacji wyników badań biologicznych uzyskanych przy zastosowaniu produktu pochodzenia naturalnego o wątpliwej specyfikacji. Problem ten nie istnieje praktycznie w badaniach sensu stricte biochemicznych, w których używa się indywidualnej substancji chemicznej o znanym stopniu czystości.
Aktywność estrogenowa
Współczesny opis efektu biologicznego związku o potencjalnych zastosowaniach terapeutycznych wymaga zdefiniowania jego działania w kategoriach molekularnych. Obserwowany w doświadczeniach z zakresu tradycyjnej farmakologii efekt biologiczny dostarcza często wystarczających wskazówek do poszukiwania biomolekularnego obiektu oddziaływań (receptora, enzymu etc.). W przypadku genisteiny, jej aktywność estrogenowa jest znana od wczesnych lat trzydziestych, co wyraźnie rzutuje także na kierunki współczesnych badań. Wiadomo, że genisteina wykazuje dość słabe powinowactwo do receptora estrogenowego, ale może konkurować z jego naturalnym substratem - estradiolem, a co więcej odpowiedni kompleks wywołuje też docelowy efekt hormonalny. Oprócz genisteiny aktywność taką stwierdzono w przypadku wielu innych związków pochodzenia roślinnego, grupowo nazwanych (w odróżnieniu od hormonów sterydowych) fitoestrogenami. Jednakże znaczenie tego faktu dla interpretacji wyników otrzymanych na modelach nowotworów hormonozależnych nie jest jasne. Generalnie przyjmuje się, że estrogeny mogą promować kancerogenezę, szczególnie nowotworu sutka. Przeciwnowotworowe działanie genisteiny w rakach prostaty i sutka, udowodnione w eksperymentach na liniach komórkowych i zwierzętach, wskazuje wyraźnie, że wnioskowanie w oparciu o jednokierunkowy model działania biologicznego tego związku nie wystarcza do opisu obserwowanych zjawisk. W badaniach na liniach komórkowych wykazano efekt genisteiny (antyproliferacyjny) zarówno w stosunku do komórek estrogenozależnych, jak i niezależnych, przy czym efekt przeciwnowotworowy osiągany był przez zatrzymanie cyklu komórkowego w stadium G2 - M, indukcji i ekspresji p21 oraz w wyniku apoptozy (Siedlecki J.A., 1998). W 1987 roku stwierdzono, że genisteina jest inhibitorem proteinowych kinaz tyrozynowych (PTK), co spowodowało lawinowy wzrost liczby publikacji na ten temat (Groundwater P.W. i inni; 1996). Kinazy tyrozynowe mogą być zlokalizowane w błonie komórkowej i wiązać aktywujący ligand (np. czynniki wzrostu: EGF - czynniki wzrostu naskórka, FGF - czynnik wzrostu fibroblastów, PDGF - czynnik wzrostu pochodzący z płytek krwi) za pomocą zewnątrzkomórkowej domeny receptorowej, ale znane są także enzymy o tej funkcji działające wyłącznie w cytozolu. Enzymy PTK pełnią niezwykle ważne role w funkcjonowaniu komórki, uczestnicząc w wytwarzaniu, modulacji i przekazywaniu sygnałów chemicznych, przenoszonych od receptora do jądra komórkowego i wywołujących ekspresję genów (Kelloff G., 2000). Znaczna część kinaz tyrozynowych jest kodowana przez onkogeny, stwierdzono także nadmierną ekspresję PTK w wielu różnych rodzajach nowotworów, skąd wynika powszechne przekonanie, że specyficzne hamowanie aktywności tych enzymów może mieć ogromne znaczenie terapeutyczne (Groundwater P.W. i inni, 1996). Wydaje się, że mechanizm molekularny odpowiedzialny za hamującą rolę genisteiny wobec PTK jest dostatecznie wyjaśniony. Z danych kinetycznych wynika, że genisteina konkuruje o miejsce aktywne z jednym z substratów enzymu, a mianowicie z 5'-trifosforanem adenozyny (ATP). W grupie enzymów PTK miejsce wiązania ATP odznacza się wysoką homologią, lecz efektywność hamująca genisteiny różni się znacznie w poszczególnych przypadkach. Co ciekawe, genisteina nie wywiera wpływu na kinazy białkowe, których substratami są reszty aminokwasów hydroksylowanych: treoniny i seryny. Natomiast motyw konkurencji z ATP o miejsce aktywne enzymu pojawia się jeszcze w innych obserwacjach dotyczących aktywności biologicznej genisteiny - stwierdzono mianowicie, że jest ona inhibitorem działania topoizomerazy II, chociaż nie charakteryzuje się zdolnością do interkalacji DNA, jak to ma miejsce w przypadku typowych inhibitorów tej grupy enzymów, np. antracyklin. Ten sposób oddziaływania na enzymy odpowiedzialne za replikację materiału genetycznego może odgrywać pewną rolę w inicjowaniu przez genisteinę apoptozy. W wielu pracach dotyczących przeciwnowotworowej aktywności genisteiny podkreśla się także silne działanie przeciwutleniające izoflawonów, a więc zdolność do usuwania na poziomie komórkowym reaktywnych i toksycznych form tlenu powstających w wyniku biotransformacji (Bartosz W., 1995).
Wpływ na zdrowie
Niewątpliwie genisteina charakteryzuje się powinowactwem do różnych biopolimerów i zdolnością modulowania wielu jednostkowych procesów biochemicznych, które składają się na kaskady i szlaki metaboliczne o decydującym znaczeniu dla utrzymania homeostazy organizmu. Chociaż nasza obecna wiedza o szczegółach tych oddziaływań jest ciągle bardzo fragmentaryczna, w wyniku prowadzonych badań ugruntowało się przekonanie o ogólnie korzystnym wpływie flawonoidów, a genisteiny w szczególności, na zdrowie ludzkie. Istotnym elementem tego przekonania jest poczucie bezpieczeństwa, wynikające z faktu, że znaczący udział flawonoidów (współcześnie, do ok. 1 g dziennie, jako suma różnych składników) pośród składników naszej diety liczy się na tysiąclecia. (Grynkiewicz G. i inni, 2000).
Biologiczne właściwości genisteiny
Pomimo relatywnie prostej struktury chemicznej genisteiny jej sposób działania ciągle pozostaje nie do końca zbadany. Liczne eksperymenty, które zostały podjęte wykazują, że genisteina interferuje z wieloma ścieżkami biochemicznymi a jej sposób działania w żywych komórkach jest kompleksowy i wielokierunkowy. Zdefiniowano kilka biochemicznych celów dla genisteiny w komórkach i obejmują one:
- proteinowe kinazy tyrozynowe,
- tropoizomerazę II,
- enzymy uczestniczące w obrocie fosfatydyloinozytolu,
- receptory estrogenne,
- transportery ABC,
- inne proteiny takie jak: kinaza rybosomalna S6; jądrowy czynnik Y/CCAAT; TGFB; CFTR; aromatazy; oksydoreduktaza 17B-hydroksysteroidowa typu I.
Cztery pierwsze proteiny stanowią główne cele a ich interakcje z genisteiną są dobrze udokumentowane. Jednakże każde z wymienionych powyżej białek może częściowo służyć za wyjaśnienie różnych efektów genisteiny, które można obserwować w kulturach komórkowych lub tkankowych. Na poziomie działania „o jeden stopień wyższym” można wyróżnić następujące biologiczne działania genisteiny, które przebadano głównie na komórkach rakowych (a - f), ale nie tylko (g – j). Większość z nich potwierdzono także w eksperymentalnych modelach zwierzęcych:
a) indukcja apoptozy,
b) indukcja różnicowania,
c) inhibicja proliferacji komórkowej,
d) modulacja cyklu komórkowego,
e) efekty antyoksydacyjne,
f) odwrócenie oporności wielolekowej na leki przeciwnowotworowe,
g) inhibicja angiogenezy,
h) hamowanie funkcji osteoklastów,
i) hamowanie pobudzenia i proliferacji limfocytów,
j) stabilizacja komórek i łagodne właściwości przeciwzapalne.
Zważywszy na wszystkie te efekty genisteiny, nic dziwnego, że istnieje przynajmniej kilka zaburzeń, w których genisteina można być zastosowana. Dlatego ostatnie badania skupiają się na zastosowaniu tego naturalnego izoflawonu w profilaktyce jak i leczeniu następujących chorób:
- nowotwory,
- postmenopauzalna utrata kości i osteoporoza,
- choroby sercowonaczyniowe,
- menopauza,
- inne choroby takie jak rodzinne chroniczne krwawienie z nosa; zwłóknienie torbielowate; alergie (Polkowski K., Mazurek A.P., 2000).
Aktywność estrogenna a budową chemiczna genisteiny
Zależność między aktywnością estrogenną a budową chemiczną genisteiny:
Przez porównanie biochemicznych właściwości genisteiny z właściwościami pokrewnych (izo)flawonoidów w różnych modelach eksperymentalnych, można oszacować, jaki motyw struktury genisteiny jest odpowiedzialny za poszczególne właściwości. Zewa i współpracownicy przebadali estrogenne i antyproliferacyjne właściwości genisteiny, ekwolu, kwercetyny i kemferolu przy wykorzystaniu linii komórek raka piersi MCF-7 in vitro. Uzyskane rezultaty ujawniły, że ekwol prawie tak samo silnym agonistą estrogenu jak genisteina, ale o wiele słabiej hamuje wzrost komórek. Dla kontrastu kwercetyna i kemferol były o wiele słabszymi agonistami estrogenu, ale prawie tak samo silnymi inhibitorami wzrostu jak genisteina. Ponadto to również sugerowało, że pozycja 4’-hydroksy na pierścieniu C i jej orientacja przestrzenna względem pozycji 7-hydroksy na pierścieniu A są głównie odpowiedzialne za estrogenność flawonoidów. Rzeczywiście grupa 4’-hydroksylowa wydaje się być najważniejszym elementem strukturalnym dla estrogennej aktywności genisteiny, ponieważ kiedy jest ona podstawiona podstawnikiem metylowy (tj. biochanina A), albo jej pozycja jest zmieniona przez przesunięcie fenolowego pierścienia C z 3- na 2- pozycję pierścienia piranu (tj. genisteina → kemferol), wiązanie z receptorem estrogennym i właściwości estrogenne maleją 10-krotnie. Co więcej, kiedy pierścień fenolowy C kemferolu jest utleniony do katecholu (tj. kwercetyna), powinowadztwo do receptora estrogenowego maleje kolejne 10 razy. Co się tyczy antyproliferacyjnych efektów genisteiny i pokrewnych związków, grupa 5-hydroksylowa i grupa ketonowa w pozycji 4 wydają się być niezbędne dla hamowania wzrostu przez (izo)flawonoidy. Podsumowując można stwierdzić, że estrogenność genisteiny i innych izoflawonoidów wynika z faktu posiadania wolnych grup hydroksylowych w pozycji 4’ i 7 (Ogarawa H. i inni, 1989).
Właściwości genisteiny, genistyny, daidzeiny i strukturalnie podobnych związków
Tabela. Niektóre z najważniejszych biochemicznych właściwości genisteiny i strukturalnie podobnych związków.
Właściwość Związek | Aktywność estrogenna | Hamowanie PTK | Hamowanie tropoizomerazy II | Hamowanie obrotu fosfatydyloinozytolu | Aktywność antyoksydacyjna | Aktywność antyproliferacyjna |
| Genisteina Genistyna Daidzeina Ekwol Biochanina A Prunetyna Kwercetyna Apigeniana Kemferol Octan flawonu Akacetyna Flawon | + + + - - - | + - - - - + + - + - - | + - - - - - - | + - + | + + +/- - - + +/- + | + - +/- - + + + + + + + |
+ związek wykazuje aktywność
+/- mniejsza aktywność od genisteiny lub istnieją pewne sprzeczności w literaturze
- związek wykazuje bardzo małą lub wcale nie wykazuje aktywności (Polkowski K., Mazurek A.P., 2000).
+/- mniejsza aktywność od genisteiny lub istnieją pewne sprzeczności w literaturze
- związek wykazuje bardzo małą lub wcale nie wykazuje aktywności (Polkowski K., Mazurek A.P., 2000).
Wzór chemiczny genisteiny, genistyny, daidzeiny i strukturalnie podobnych związków
Wzory genisteiny i strukturalnie podobnych związków (Polkowski K., Mazurek A.P., 2000):
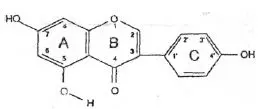 Genisteina | 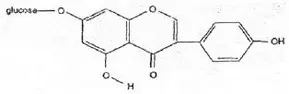 Genistyna |
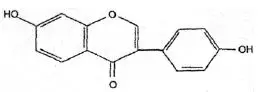 Daidzeina | 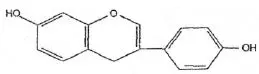 Ekwol |
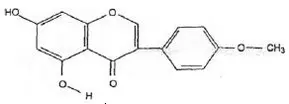 Biochanina A | 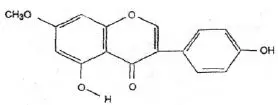 Prunetyna |
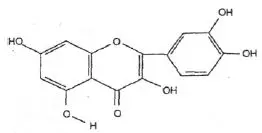 Kwercetyna | 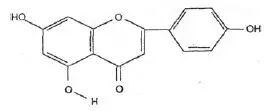 Apigeniana |
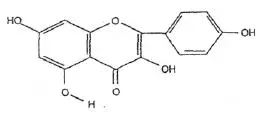 Kemferol | 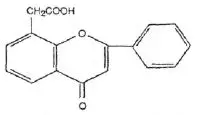 Octan flawonu |
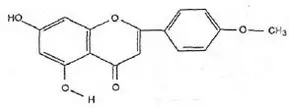 Akacetyna | 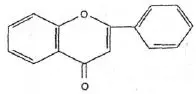 Flawon |
Badania:
Estrogenność genisteiny
Estrogenna aktywność genisteiny, obserwowana w diecie bogatej w fitoestrogeny, została bezpośrednio potwierdzona w seriach eksperymentów in vivo i in vitro.
Różne linie komórek nowotworowych, które posiadają funkcjonalny system receptorów estrogennych zwiększają tempo proliferacji w odpowiedzi na leczenie estradiolem. W takich komórkach genisteina w niskich stężeniach może naśladować działanie estradiolu i stymulować wzrost komórek. Ponadto te rezultaty mogą być odtworzone in vivo w następującym modelu eksperymentalnym: Pozbawionym grasicy myszom wszczepiono podskórnie estrogenozależne komórki nowotworu piersi MCF-7 i karmiono standardową dietą (ujemna grupa kontrolna) lub dietą wzbogaconą o genisteinę. Dodatnia grupa kontrolna otrzymała podskórnie pigułkę estradiolu. Guzy były większe w grupach otrzymujących estradiol i genisteinę, niż w negatywnej grupie kontrolnej, wskazując, że genisteina jest zdolna działać jak agonista estrogenu in vivo (Hsieh C.Y. i inni, 1998). W innych eksperymentach zastosowano metodę ważenia macicy niedojrzałych myszy, aby przebadać estrogenność genisteiny. Izoflawon był podawany podskórnie lub doustnie a po czterech dniach masa macicy została oceniona. Genisteina stymulowała wzrost macicy w sposób zależny od dawki a jej aktywność oszacowano w przybliżeniu równą 1/50,000 aktywności dietylostylbesterolu – syntetycznego związku estrogennego (Cheng E. i inni, 1953). Podobne rezultaty uzyskano na bezgrasicznych myszach, którym usunięto jajniki, aby pozbawić ich naturalnych estrogenów. W tym przypadku była w stanie zastąpić estrogenny estradiol, ponieważ powodowała wzrost masy macicy myszy jak również wzrost gruczołu sutkowego (Hsieh C.Y. i inni, 1998).
Estrogenna aktywność genisteiny może być także zademonstrowana przez jej efekty na stan kości. Dla przykładu, przynasadowe tkanki udowe uzyskane z dojrzałych samic szczurów były hodowane in vitro w obecności czynników resorbujących kości: LPS (lipopolisacharydu, PGE2 (prostaglandyny E2), czy PTH (parathormonu). Genisteina w stężeniach 0,1 – 10 µM/l całkowicie hamowała degradację kości mierzoną przez zawartość wapnia w kości, przez co dokładnie naśladowała działanie estradiolu. Dodatkowo efekt protekcyjny genisteiny był zniesiony w obecności klasycznego antyestrogenu, którym był tamoksifen (Yamaguchi M., Gao Y.H., 1998). Podobne wnioski zostały wyciągnięte z badań nad efektami anabolicznymi genisteiny na metabolizm kości in vitro. Tak jak estradiol, genisteina wzmaga budowę kości, o czym świadczy wzrost zawartości wapnia i DNA oraz wzrost aktywności fosfatazy zasadowej, co znowu może być zablokowane przez tamoksifen (Yamaguchi M., Gao Y.H., 1997). Estrogenopodobne efekty genisteiny zostały również pokazane in vivo w zwierzęcych modelach osteoporozy. Leczenie genisteiną samic szczurów z usuniętymi jajnikami dawało wyniki procentowo równe zatrzymaniu mineralnej masy kostnej jak przy fizjologicznych dawkach estradiolu (Anderson J.J. i inni, 1998).
Hamowanie funkcji osteoklastów
Ostatnie badania ujawniły, że genisteina jest bardzo silnym inhibitorem osteoklastów i znacznie zmniejsza resorpcję kości w eksperymentach in vitro. Traktowane genisteiną osteoklasty w kulturach tkanki kostnej traciły zdolność degradacji kości, co oceniono przez zmniejszenie produkcji kwasu mlekowego, średnie zużycie glukozy i aktywność fosfatazy kwaśnej. Co istotne wszystkie te zjawiska występowały przy relatywnie niskich stężeniach genisteiny sięgających od 0,1 do 10 µM/l. Według rezultatów uzyskanych przez Yamaguchi`ego i jego współpracowników (Yamaguchi M., Gao Y.H., 1998), efekt genisteiny hamujący resorpcję kości wiązał się z estrogrenopodobnym działaniem tego izoflawonu. Oprócz tego działania genisteiny sugeruje się także hamowanie funkcji osteoklastów przez zahamowanie proteinowych kinaz tyrozynowych. To może być słuszne, ponieważ komórki kościogubne są zwykle zależne od aktywności kinaz tyrozynowych. W tym samym czasie synteza protein osteoklastów była znacząco obniżona tylko przy stężeniach genisteiny trzy razy większych od tych, które blokowały resorpcję kości, co sugeruje niską toksyczność tego izoflawonu (Bliar H.C. i inni, 1996).
Toksyczność genisteiny
Zagadnienie toksyczności genisteiny powinno być rozważane w dwóch kategoriach. Pierwsza dotyczy genisteiny jako związku chemoprewencyjnego podawanego przez dłuższy czas. W tej sprawie prawie pięć tysięcy lat konsumpcji soi w południowo-wschodniej Azji wydaje się udowadniać, że chroniczne spożywanie małych ilości genisteiny nie jest toksyczne dla ludzi, (chociaż inne gatunki mogą być wrażliwe np. owce i gepardy). Dlatego u osób często spożywających soję stężenie genisteiny w osoczu wynosi 1-5 µM/l (Barnes S., 1995), w większości występuje ona w postaci połączeń z glukuronidami i siarczanami. Taki poziom genisteiny nie jest związany z żadnymi niekorzystnymi efektami, a wręcz przeciwnie, jest korzystny dla zdrowia. Podobne wnioski zostały wyciągnięte z badań na zwierzętach. Na przykład, sześć miesięcy diety wzbogaconej w proteiny sojowe nie wywarła efektów ubocznych na system rozrodczy rezusów znajdujących się w okresie przed pokwitaniem, co oceniono przez zbadanie stężenia hormonów płciowych i wagi organów podczas sekcji zwłok (Anthony M.S. i inni, 1996).
Druga kategoria dotyczy toksyczności genisteiny jako potencjalnego leku podawanego w wyższych dawkach. Temat ten nie jest jeszcze dokładnie zbadany, ale istnieją pewne dane, które sugerują, że genisteina również nie jest toksyczna w tych przypadkach. Dlatego nie zaobserwowano żadnej ostrej toksyczności po dootrzewnowym podaniu 100mg/kg masy ciał myszy a nawet 500mg/kg w innym eksperymencie (Asahi K.I. i inni, 1981; Ogawara H. i inni, 1986). Jeśli przyjmie się, że genisteina równoważy się z całkowitą ilością wody w organizmie (Barnes S., 1995), to takie dawki, natychmiast po wstrzyknięciu, dawałyby stężenia w osoczu odpowiednio 620 i 3080 µM/l, podczas gdy na przykład dla działania przeciwnowotworowego w eksperymentach in vitro wystarczyła dawka 5-40 µM/l. Toksyczność tego izoflawonu została również oceniona w badaniach, które miały na celu przebadać szczególne działanie genisteiny na zwierzętach laboratoryjnych. Na przykład, genisteina była podawana samicom szczurów w dawkach 60 mg/kg masy ciała, aby zbadać jej wpływ na utratę kości. Podczas 30 dni takiej diety masy zwierząt badanych i kontrolnych były nie do odróżnienia, wskazując na brak toksyczności (Bliar H.C. i inni, 1996). W innym eksperymencie trzy wysokie dawki (500 mg/kg, co drugi dzień) genisteiny podawane samicom szczurów w okresie przed pokwitaniem były bez znaczącej toksyczności dla systemu endokrynno/rozrodczego tych zwierząt (Murril W.B. i inni, 1996).
Podsumowując niskie dawki genisteiny z pewnością nie wywierają efektów toksycznych na ludzi, o czym świadczy historia konsumpcji soji. Wpływ wyższych dawek, mających działanie przeciwnowotworowe, nie został dokładnie zbadany, ale dostępne dane literaturowe sugerują, że genisteina nie jest toksyczna również w tych przypadkach (Polkowski K., Mazurek A.P., 2000).
Postmenopauzalna utrata masy kostnej i osteoporoza
Postmenopauzalny brak estrogenu prowadzi do poważnych konsekwencji obejmujących między innymi utratę masy kostnej, czego wynikiem jest osteoporoza. Jednakże kobiety spożywające soję i jej przetwory i wskutek tego wystawione na działanie genisteiny są mniej narażone na wystąpienie tej choroby (Zawa D.T., Duwe G., 1997). Genisteina wywiera całkiem znaczące działanie estrogenne i dlatego może być skutecznym czynnikiem w zachowaniu masy kostnej. Zwierzęce modele badań na szczurach z usuniętymi jajnikami (pozbawionymi endogennych estrogenów) dowiodły, że genisteina jest równie aktywna jak estrogeny w utrzymaniu zdrowych kości (Anderson J.J. i inni, 1998). W kulturach tkankowych in vitro genisteina, podobnie jak estradiol, wywierała znaczące działanie protekcyjne przy doświadczalnie zwiększonej resorpcji kości (Yamaguchi M., Gao Y.H., 1998), a ponadto stymulowała, za pośrednictwem osteoblastów, budowę kości, co oznacza, że wykazuje efekty anaboliczne (Yamaguchi M., Gao Y.H., 1997). Co więcej na podstawie porównawczych badań z modelowymi inhibitorami proteinowych kinaz tyrozynowych, doniesiono, że genisteina blokuje funkcje osteoklastów in vitro przez mechanizm kinazy tyrozynowej. Uznano także, że ten mechanizm posiada znaczenie in vivo sugerując, że efekty genisteiny dla zdrowia kości nie są ograniczone do agonizmu względem receptora estrogenowego. Podsumowując, jakikolwiek jest sposób działania genisteiny wydaje się ona być bardzo silnym czynnikiem w zapobieganiu osteoporozie. Ten wniosek może być poparty przez rezultaty próby klinicznej przeprowadzonej na 66 postmenopauzalnych kobietach, które przez sześć miesięcy otrzymywały dietę wzbogaconą w sojowe izoflawony. Takie leczenie prowadziło do znaczącego wzrostu zawartości i gęstości mineralnej kości w lędźwiowym odcinku kręgosłupa (Potter S.M. i inni, 1998). Te korzyści dla zdrowia mogą być, przynajmniej częściowo, przypisane genisteinie, ponieważ jest ona dominującym i najbardziej aktywnym izoflawonem sojowym (Polkowski K., Mazurek A.P., 2000).
Menopauza
Odkrycia epidemiologiczne pokazują, że azjatyckie kobiety w okresie postmenopauzalnym, które stosują bogatą w soję dietę mają mniej problemów zdrowotnych, powszechnie związanych z niedoborem estrogenu takich, jak osteoporoza, choroby sercowonaczyniowe i symptomy menopauzy. Chociaż wchodzą w okres menopauzy szybciej i mają o połowę mniejsze poziomy krążących estradiolu i estronu niż amerykanki rasy kaukaskiej (Zawa D.T., Duwe G., 1997). Korzyści dla zdrowia są przypisywane pochodzącej z soi genisteinie, która jak się uważa, zastępuje brak ludzkich endogennych estrogenów, łagodząc efekty ich braku. Faktycznie, genisteina jest zdolna do łagodzenia symptomów menopauzy takich jak depresja, uderzenia gorąca, bezsenność, rozdrażnienie itd. (Polkowski K., Mazurek A.P.; 2000).


